- согласно указу президента РФ №187 от 17 марта 2020 года о дистанционной продаже безрецептурных лекарств, осуществляется доставка на дом безрецептурных лекарственных средств, а также БАД, медицинских изделий, товаров для дома и красоты, бытовой химии и сопутствующих товаров. Доставка рецептурных лекарств, при наличии рецепта выписанного врачом, осуществляется до аптеки. Доставка рецептурных лекарств физическим лицам возможна только для льготной категории граждан на основании ст. 2 Федерального закона РФ N 5-ФЗ и ст 1.1 Закона РФ N 4301-1, либо фармацевтическим работником, либо 'под контролем' провизора, который несет за это ответственность.
Аптека "Лекарь Райниса", бульвар Яна Райниса 2к1, метро Сходненская
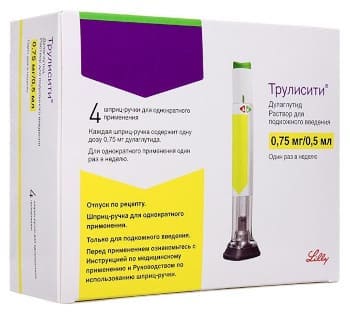
ТРУЛИСИТИ 750 МКГ. / 0.5 МЛ. РАСТВОР П-К № 4
- Производитель:
- ЛИЛЛИ / ELI LILLY AND CO.
- Название товара:
- ТРУЛИСИТИ 750 МКГ. / 0.5 МЛ. РАСТВОР П-К № 4
- Цена:
- 18000 ₽
Минимальная сумма заказа = 500 руб. Цена товара округлена до целых рублей.
Смотрите все условия заказа: Трулисити в аптеках.
Аналоги, дженерики (активное вещество): Дулаглутид.
Информация о препарате «Трулисити» не должна быть использована в качестве руководства по самолечению. Приём лекарственного препарата необходимо согласовать с лечащим врачом!
Трулисити: Инструкция
Побочное действие
Обзор профиля безопасности препарата Трулисити
В ходе проведенных клинических исследований II и III фазы 4006 пациентов получали дулаглутид в виде монотерапии или в сочетании с другими гипогликемическими препаратами. Наиболее частыми нежелательными реакциями в клинических исследованиях были реакции со стороны желудочно-кишечного тракта, включая тошноту, рвоту и диарею. В целом, данные реакции были легкими или умеренными и временными по характеру.
Приведенные ниже нежелательные реакции при применении препарата Трулисити были выявлены в ходе оценки результатов клинических исследований II и III фазы; они указаны в соответствии с поражением органов и систем органов в порядке уменьшения частоты (очень часто: ≥1/10; часто: ≥1/100 - <1/10; нечасто: ≥1/1000 - <1/100; редко: ≥1/10000 - <1/1000; очень редко: <1/10000).
Со стороны иммунной системы: нечасто - гиперчувствительность; редко - анафилактическая реакция *.
Нарушения обмена веществ и питания: очень часто - гипогликемия** (при применении в сочетании с инсулином, глимепиридом, метформином *** или метформином и глимепиридом); часто - гипогликемия ** (при применении в качестве монотерапии или в сочетании с метформином и пиоглитазоном).
Со стороны желудочно-кишечного тракта (ЖКТ): очень часто - тошнота, диарея, рвота ***, боль в животе ***; часто - снижение аппетита, диспепсия, запор, метеоризм, вздутие живота, гастроэзофагеальная рефлюксная болезнь (ГЭРБ), отрыжка; редко - острый панкреатит.
Со стороны кожи и подкожной клетчатки: редко - ангионевротический отек *.
Общие расстройства и нарушения в месте введения: часто - слабость; нечасто - реакции в месте введения.
Лабораторные и инструментальные данные: часто - синусовая тахикардия, атриовентрикулярная (AV) блокада I степени.
*- постмаркетинговый опыт применения.
** - документированная симптоматическая гипогликемия и концентрация глюкозы крови ≤3,9 ммоль/л.
*** - только для дулаглутида в дозе 1,5 мг. Частота нежелательных реакций для дулаглутида в дозе 0,75 мг соответствует более низкой категории.
Описание отдельных нежелательных реакций
Гипогликемия
При применении дулаглутида в дозах 0,75 мг или 1,5 мг 1 раз в неделю в виде монотерапии или в сочетании с метформином или метформином и пиоглитазоном частота документированной симптоматической гипогликемии составляла от 5,9% до 10,9% или от 0,14 до 0,62 явлений/пациент/год, случаев тяжелой гипогликемии не отмечалось.
При применении дулаглутида в дозах 0,75 мг или 1,5 мг 1 раз в неделю в сочетании с производными сульфонилмочевины (плюс метформин) частота документированной симптоматической гипогликемии составляла 39% и 40,3% или 1,67 и 1,67 явлений/пациент/год соответственно. Частота явлений тяжелой гипогликемии составляла 0% и 0,7% или 0 и 0,01 явлений/пациент/год соответственно.
При применении дулаглутида в дозах 0,75 мг или 1,5 мг 1 раз в неделю в сочетании с прандиальным инсулином частота гипогликемии составляла 85,3% и 80% или 35,66 и 31,06 явлений/пациент/год соответственно. Частота явлений тяжелой гипогликемии составляла 2,4% и 3,4% или 0,05 и 0,06 явлений/пациент/год соответственно.
Нежелательные реакции со стороны желудочно-кишечного тракта
Совокупная отчетность о явлениях со стороны желудочно-кишечного тракта в течение периода до 104 недель при применении дулаглутида в дозах 0,75 мг или 1,5 мг 1 раз в неделю соответственно, включали тошноту (12,9% и 21,2%), диарею (10,7% и 13,7%) и рвоту (6,9% и 11,5%). Обычно они имели легкую или умеренную степень тяжести, их максимальная частота отмечалась в течение первых 2-х недель терапии и быстро снижалась в течение следующих 4-х недель, после чего частота оставалась относительно постоянной.
В клинико-фармакологических исследованиях, которые проводились с участием пациентов с сахарным диабетом 2 типа и продолжались до 6 недель, большинство явлений со стороны желудочно-кишечного тракта отмечались в течение первых 2 - 3-х дней после приема первой дозы, их частота снижалась при применении следующих доз.
Острый панкреатит
Частота острого панкреатита в клинических исследованиях II и III фазы составила 0,07% при применении дулаглутида по сравнению с 0,14% при применении плацебо и 0,19% при применении препаратов сравнения, при дополнительной базовой гипогликемической терапии или без нее.
Ферменты поджелудочной железы
Применение дулаглутида связано со средним увеличением активности ферментов поджелудочной железы (липазы и/или панкреатической амилазы) на 11 - 21% по сравнению с исходными показателями. В отсутствие других признаков и симптомов острого панкреатита повышение активности ферментов поджелудочной железы не является прогностическим фактором для развития острого панкреатита.
Увеличение частоты сердечных сокращений
При применении дулаглутида в дозах 0,75 мг или 1,5 мг 1 раз в неделю наблюдалось небольшое среднее увеличение частоты сердечных сокращений на 2 - 4 уд/мин и частоты синусовой тахикардии на 1,3% и 1,4% соответственно, которая сопровождалась увеличением по сравнению с исходным показателем на ≥15 уд/мин.
Атриовентрикулярная блокада I степени и увеличение интервала РR
При применении дулаглутида в дозах 0,75 мг или 1,5 мг 1 раз в неделю наблюдалось небольшое среднее увеличение интервала PR на 2 - 3 мс, по сравнению с исходным показателем, и частоты атриовентрикулярной блокады I степени на 1,5% и 2,4% соответственно.
Иммуногенность
В ходе клинических исследований применение дулаглутида сопровождалось выявлением появившихся в ходе терапии антител к дулаглутиду с частотой 1,6%, что указывает на то, что структурные изменения в глюкагоноподобном пептиде 1 (ГПП-1) и модифицированные участки IgG4 в молекуле дулаглутида наряду с высокой гомологичностью нативному ГПП-1 и нативному IgG4 минимизируют риск развития иммунного ответа при терапии дулаглутидом. Пациенты, у которых вырабатывались антитела к дулаглутиду, обычно имели низкий титр антител; тем не менее, несмотря на небольшое число пациентов, у которых формировались антитела к дулаглутиду, оценка результатов клинических исследований III фазы не выявила явного влияния антител к дулаглутиду на изменение показателя НbА1с.
Гиперчувствительность
В клинических исследованиях II и III фазы явления системной гиперчувствительности (тяжелая крапивница, обширные высыпания, отек лица, отек губ) наблюдались у 0,5% пациентов, которые получали дулаглутид. Ни у одного пациента с системной гиперчувствительностью не вырабатывались антитела к дулаглутиду.
Реакиии в месте введения
Реакции в месте введения наблюдались у 1,9% пациентов, получавших дулаглутид. Потенциально иммуноопосредованные нежелательные явления в месте инъекции (например, сыпь, эритема) отмечались у 0,7% пациентов и обычно были легкими.
Досрочное прекращение участия в клинических исследованиях по причине нежелательного явления
В ходе исследований продолжительностью 26 недель частота досрочного прекращения участия по причине нежелательных явлений составляла 2,6% (0,75 мг 1 раз в неделю) и 6,1% (1,5 мг 1 раз в неделю) при применении дулаглутида по сравнению с 3,7% при применении плацебо. На всем протяжении исследования (до 104 недель) частота досрочного прекращения участия по причине нежелательных явлений при применении дулаглутида составляла 5,1% (0,75 мг 1 раз в неделю) и 8,4% (1,5 мг 1 раз в неделю). Наиболее частыми нежелательными реакциями, которые вели к досрочному прекращению участия в группах применения дулаглутида в дозах 0,75 мг или 1,5 мг 1 раз в неделю, были тошнота (1% и 1,9%), диарея (0,5% и 0,6%) и рвота (0,4% и 0,6%), в основном такие реакции отмечались в течение первых 4 - 6 недель терапии.